二元化合物は、2つの異なる化学元素によって形成される物質です。この用語は、無機化合物の定性的および定量的組成を示すために使用されます。
二元化合物は重要であると考えられています物質の性質の研究におけるオブジェクト。それらを説明するとき、次の概念が使用されます:結合分極、酸化状態、原子価。これらの化学用語は、化学結合の形成の本質、無機物質の構造的特徴を理解することを可能にします。
二元化合物の主なクラス、それらの化学構造と特性の特徴、およびそれらの工業的応用のいくつかの領域を考えてみましょう。

酸化物
このクラスの無機物質は、自然界で最も一般的です。このグループの化合物の有名な代表者の中で、次の点を強調します。
- 酸化ケイ素(川砂);
- 酸化水素(水);
- 二酸化炭素;
- 粘土(酸化アルミニウム);
- 鉄鉱石(酸化鉄)。
このような二元化合物は複雑な物質であり、必然的に酸素を含み、-2の酸化状態を示します。
酸化物の凝集状態
銅、カルシウム、鉄の化合物は結晶性固体。同じ凝集状態には、六価硫黄、五価リン、シリコンなどのいくつかの非金属の酸化物があります。通常の状態での液体は水です。非金属の酸素化合物の大部分はガスです。
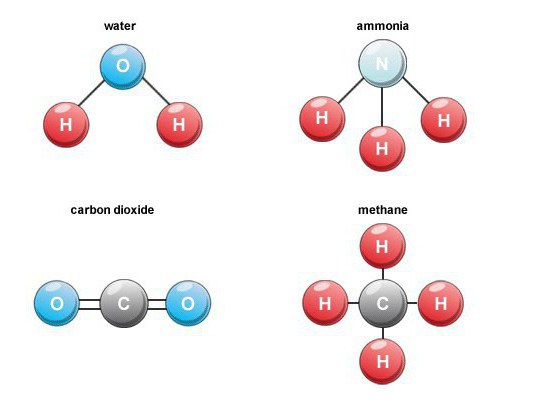
教育の特徴
多くの二元酸素化合物が形成されます本来は。例えば、燃料の燃焼、呼吸、有機物の腐敗の間に、二酸化炭素(一酸化炭素4)が形成されます。空中では、その体積含有量は約0.03パーセントです。
同様の二元化合物は製品です火山の活動だけでなく、ミネラルウォーターの不可欠な部分。二酸化炭素は燃焼をサポートしないため、この化合物は消火に使用されます。
揮発性水素化合物
このような二元化合物は重要なグループです水素を含む物質。産業上重要な代表者の中で、メタン、水、硫化水素、アンモニア、およびハロゲン化水素に注目します。
いくつかの揮発性水素化合物は土壌水や生物に存在するので、それらの地球化学的および生化学的役割について話すことができます。
このタイプの二元化合物を構成するために、最初に原子価を持つ水素が置かれます。 2番目の元素は、負の酸化状態を持つ非金属です。
バイナリ結合でインデックスを配置するには原子価の間で、最小公倍数が決定されます。各元素の原子数は、化合物の一部である各元素の原子価で割ることによって決定されます。

塩化水素
二元化合物の式を考えてみましょう。塩化水素とアンモニア。現代の化学産業にとって重要なのはこれらの物質です。通常の条件下でのHClはガス状の化合物であり、水に非常によく溶けます。塩化水素ガスが溶解した後、塩酸が生成され、多くの化学プロセスや製造チェーンで使用されます。
この二元化合物は、人間や動物の胃液に含まれており、食物とともに胃に侵入する病原性微生物に対するバリアです。
塩酸の主な用途の中で、塩化物の製造、塩素含有製品の合成、金属の酸洗い、酸化物と炭酸塩からのパイプの洗浄、皮革産業を選び出します。
式NHを持つアンモニア3、無色のガスです特定の刺激臭。水への溶解度が無制限であるため、医学で求められているアンモニアを得ることができます。自然界では、この二元化合物は、窒素を含む有機生成物の崩壊中に形成されます。

酸化物の分類
原子価が1または2の金属の酸素含有二元化合物が塩基性酸化物です。たとえば、このグループには、アルカリおよびアルカリ土類金属の酸化物が含まれます。
非金属の酸化物、および4を超える原子価を持つ金属は、酸性化合物です。
化学的性質に応じて、このクラスの代表者は塩を形成するグループと塩を形成しないグループに分けられます。
2番目のグループの典型的な代表の中で、一酸化炭素(CO)、一酸化窒素1(NO)に注目します。
化合物の体系的な名前の形成
合格した卒業生に提供されるタスクの中で化学の状態試験では、これもあります:「硫黄(窒素、リン)の可能な二元酸素化合物の分子式を作成する」。この課題に対処するためには、アルゴリズムだけでなく、このクラスの無機物質の命名法の特徴についても考える必要があります。
バイナリの名前を形成するとき化合物は、最初に式の右側にある要素を示し、接尾辞「id」を追加します。次に、最初の要素の名前を示します。共有化合物の場合、接頭辞が追加されます。これにより、二元化合物の構成部分間の定量的な比率を確立できます。
たとえばSO3 –三酸化硫黄、N2ああ4 –四酸化二窒素、I2CL6 –ダイオードヘキサクロライド。
二元化合物に異なる酸化状態を示すことができる化学元素が含まれている場合、酸化状態は化合物の名前の後に括弧内に示されます。
たとえば、2つの鉄化合物は名前が異なります:FeCL3 -酸化鉄(3)、FeCL2 –酸化鉄(2)。
水素化物、特に非金属元素の場合、慣用名が使用されます。はい、H2O-水、HCL-塩化水素、HI-ヨウ化水素、HF-フッ化水素酸。

カチオン
それらの元素の陽イオン安定したイオンを1つだけ形成でき、記号自体と同じ名前を付けます。これらには、メンデレーエフの周期表の第1および第2グループのすべての代表者が含まれます。
たとえば、ナトリウムとマグネシウムの陽イオンの形式は次のとおりです。Na+、Mg2+。遷移元素はいくつかのタイプの陽イオンを形成できるため、名前は個々のケースに現れる原子価を示す必要があります。
陰イオン
単純な(単原子)および複雑な(多原子)陰イオンの場合、接尾辞-idが使用されます。
特定の一般的なオキソアニオン要素は接尾辞-amです。酸化状態の低い式に含まれる元素のオキソアニオンには、接尾辞-itが使用されます。接頭辞hypo-は最小の酸化状態に使用され、per-は最大値に使用されます。たとえば、Oイオン2- は酸化物イオンであり、O- -過酸化物。
水素化物にはさまざまな慣用名もあります。たとえば、N2X4 ヒドラジンと呼ばれ、PH3 ホスフィンと呼ばれます。
硫黄含有オキソアニオンの名前は次のとおりです。
- そう42- -硫酸塩;
- と2ああ32- -チオ硫酸塩;
- NCS- -チオシアン酸塩。
塩
化学の多くの最終テストは提供します次のタスク:「金属の二元化合物の式を作成します。」そのような化合物が塩素、臭素、ヨウ素の陰イオンを含む場合、そのような化合物はハロゲン化物と呼ばれ、塩のクラスに属します。これらの二元化合物を配合する場合、最初に金属を配置し、次に対応するハロゲン化物イオンを配置します。
各元素の原子数を決定するために、原子価間の最小公倍数が求められます。除算すると、インデックスが取得されます。
これらの化合物は高い融点を持っています。沸騰し、水への溶解度が高く、通常の条件下では固体です。たとえば、塩化ナトリウムと塩化カリウムは海水の一部です。
塩は古くから人々に使われてきました。現在、この二元化合物の使用は食べることに限定されていません。塩化ナトリウムの水溶液を電気分解すると、金属ナトリウムと塩素ガスが発生します。これらの製品は、水酸化ナトリウム、塩化水素などのさまざまな工業プロセスで使用されます。
二元化合物の意味
このグループには多数が含まれます物質なので、人間の活動のさまざまな分野でのそれらの使用の規模について自信を持って話すことができます。アンモニアは、化学産業で硝酸の製造および無機肥料の製造の前駆体として使用されます。微細な有機合成に使用され、長い間冷凍に使用されてきたのはこの二元化合物です。
炭化タングステンの独特の硬度のために、このコンパウンドは、さまざまな切削工具の製造に使用されています。この二元化合物の化学的不活性により、実験装置、炉などの過酷な環境での使用が可能になります。
全身麻酔の薬には、酸素を混ぜた「笑気ガス」(一酸化窒素1)が使われています。
すべての二元化合物は、化学結合の共有結合またはイオン性、分子、イオン、または原子の結晶格子を持っています。

結論
二元化合物の式をコンパイルする場合アクションの特定のアルゴリズムに従う必要があります。正の酸化状態を示す(電気的負の値が低い)要素が最初に書き込まれます。 2番目の元素の酸化状態の値を決定するとき、それが位置するグループの数が8から差し引かれます。得られた数値が互いに異なる場合、最小公倍数が決定され、次にインデックスが計算されます。
酸化物に加えて、これらの化合物には以下が含まれます炭化物、ケイ化物、過酸化物、水素化物。アルミニウムとカルシウムの炭化物はメタンとアセチレンの実験室での生産に使用され、過酸化物は化学産業で強力な酸化剤として使用されます。
フッ化水素(フッ化水素酸)などのハロゲン化物酸)、はんだ付けのための電気工学で使用されます。生物の存在を想像するのが難しい最も重要な二元化合物の中で、水が先頭に立っています。この無機化合物の構造的特徴は、学校の化学コースで詳細に研究されています。彼女の例では、二元化合物の式をコンパイルするときに、一連のアクションのアイデアを得ることができます。
結論として、さまざまな二元化合物が使用されている場所では、そのような現代産業の領域、人間の生活の領域を見つけるのは難しいことに注意してください。