Razina znanja o građi atoma i molekula u XIXstoljeća nije dopuštao objasniti razlog zašto atomi tvore određeni broj veza s drugim česticama. No, ideje znanstvenika bile su ispred svog vremena, a valencija se još uvijek proučava kao jedan od osnovnih principa kemije.
Iz povijesti nastanka koncepta "valencije kemijskih elemenata"
Istaknuti engleski kemičar iz 19. stoljeća EdwardFrankland je uveo pojam "veza" u znanstvenu upotrebu kako bi opisao proces međusobne interakcije atoma. Znanstvenik je primijetio da neki kemijski elementi tvore spojeve s istim brojem drugih atoma. Na primjer, dušik veže tri atoma vodika na molekulu amonijaka.

U svibnju 1852. Frankland je iznio hipotezu oda postoji određeni broj kemijskih veza koje atom može stvoriti s drugim sitnim česticama tvari. Frankland je upotrijebio izraz "vezna sila" da opiše ono što će se kasnije nazvati valencija. Britanski kemičar ustanovio je koliko kemijskih veza čini atome pojedinih elemenata, poznatih sredinom 19. stoljeća. Franklandov rad postao je važan doprinos modernoj strukturnoj kemiji.

Razvoj pogleda
Njemački kemičar F.A.Kekulé je 1857. dokazao da je ugljik tetrabazičan. U njegovom najjednostavnijem spoju, metanu, veze nastaju s 4 atoma vodika. Znanstvenik je koristio izraz "bazičnost" za označavanje svojstava elemenata za pričvršćivanje strogo definirane količine drugih čestica. U Rusiji je podatke o strukturi materije sistematizirao A.M. Butlerov (1861). Teorija kemijske veze dodatno je razvijena zahvaljujući doktrini o periodičnim promjenama svojstava elemenata. Njegov autor je još jedan izvanredni ruski kemičar, DI Mendeljejev. On je dokazao da su valencija kemijskih elemenata u spojevima i druga svojstva posljedica položaja koji oni zauzimaju u periodnom sustavu.


Sposobnost vizualizacije molekula je jedna stvarod nedvojbenih zasluga teorije valencije. Prvi modeli pojavili su se 1860-ih, a od 1864. koriste se strukturne formule, a to su krugovi s kemijskim znakom unutar. Crtica između simbola atoma označava kemijsku vezu, a broj tih linija jednak je vrijednosti valencije. Iste godine proizvedeni su i prvi modeli s kuglom i palicom (vidi sliku lijevo). Godine 1866. Kekulé je predložio stereokemijski crtež ugljikovog atoma u obliku tetraedra, koji je uključio u svoj udžbenik "Organska kemija".
Valencija kemijskih elemenata i pojavaveze proučavao je G. Lewis, koji je svoje radove objavio 1923. nakon otkrića elektrona. Ovo je naziv najmanjih negativno nabijenih čestica koje su dio ljuski atoma. U svojoj knjizi, Lewis je koristio točkice oko četiri strane kemijskog simbola za predstavljanje valentnih elektrona.
Valencija vodika i kisika
Prije stvaranja periodnog sustava, valencijaBilo je uobičajeno uspoređivati kemijske elemente u spojevima s onim atomima po kojima je poznat. Za standarde su odabrani vodik i kisik. Drugi je kemijski element privukao ili zamijenio određeni broj atoma H i O.

Na taj su način određena svojstva u spojevima s jednovalentnim vodikom (valenca drugog elementa označena je rimskim brojem):
- HCl - klor (I):
- X2O je kisik (II);
- NH3 - dušik (III);
- B4 - ugljik (IV).
U oksidima K2O, CO, N2oh3, SiO2CO3 valencija kisika metala i nemetala određena je udvostručenjem broja dodanih atoma O. Dobivene su sljedeće vrijednosti: K (I), C (II), N (III), Si (IV), S ( VI).
Kako odrediti valenciju kemijskih elemenata
Postoje pravilnosti u stvaranju kemijske veze uz sudjelovanje zajedničkih elektronskih parova:
- Tipična valencija vodika je I.
- Uobičajena valencija kisika je II.
- Za nemetalne elemente, najniža valencija se može odrediti formulom 8 - brojem skupine u kojoj se nalaze u periodnom sustavu. Najviši, ako je moguće, određuje se brojem grupe.
- Za elemente sekundarnih podskupina, maksimalna moguća valencija jednaka je broju njihove grupe u periodnom sustavu.
Određivanje valencije kemijskih elemenata formulom spoja provodi se pomoću sljedećeg algoritma:
- Napišite poznatu vrijednost za jedan od elemenata iznad kemijskog znaka. Na primjer, u Mn2oh7 valencija kisika je II.
- Izračunajte ukupnu vrijednost za koju je potrebno valenciju pomnožiti s brojem atoma istog kemijskog elementa u molekuli: 2 * 7 = 14.
- Odredi valenciju drugog elementa za koji je nepoznat. Podijelite vrijednost dobivenu u koraku 2 s brojem atoma Mn u molekuli.
- 14: 2 = 7. Valencija mangana u njegovom višem oksidu je VII.
Konstantna i promjenjiva valencija
Valentne vrijednosti za vodik i kisik su različite. Na primjer, sumpor u spoju H2S je dvovalentan, au formuli SO3 - heksavalentna. Ugljik s kisikom stvara CO monoksid i CO dioksid2... U prvom spoju valencija C je II, a u drugom IV. Ista vrijednost u metanu CH4.

Većina elemenata nije konstantna, većpromjenjive valencije, na primjer, fosfor, dušik, sumpor. Potraga za glavnim razlozima ovog fenomena dovela je do pojave teorija kemijske veze, koncepata valentne ljuske elektrona, molekularnih orbitala. Postojanje različitih vrijednosti istog svojstva objašnjeno je sa stanovišta strukture atoma i molekula.
Suvremeni koncepti valencije
Svi atomi se sastoje od pozitivne jezgre,okružen negativno nabijenim elektronima. Vanjska ljuska, koju oni formiraju, je nedovršena. Završena struktura je najstabilnija, sadrži 8 elektrona (oktet). Pojava kemijske veze zbog zajedničkih elektronskih parova dovodi do energetski povoljnog stanja atoma.
Pravilo za formiranje veza jedovršavanje ljuske prihvaćanjem elektrona ili odustajanjem od nesparenih elektrona, ovisno o tome koji je proces lakši. Ako atom daje negativne čestice koje nemaju par za stvaranje kemijske veze, tada stvara onoliko veza koliko ima nesparenih elektrona. Prema suvremenim konceptima, valencija atoma kemijskih elemenata je sposobnost stvaranja određenog broja kovalentnih veza. Na primjer, u molekuli sumporovodika H2S sumpor poprima valenciju II (-), budući dasvaki atom sudjeluje u formiranju dva elektronska para. Znak "-" označava privlačenje elektronskog para na elektronegativniji element. Za manju elektronegativnu vrijednost valencije dodajte "+".
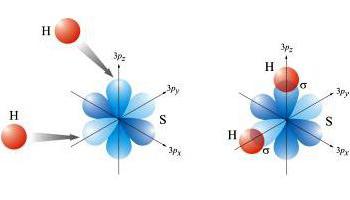
Uz mehanizam donor-akceptor, u proces su uključeni parovi elektrona jednog elementa i slobodne valentne orbitale drugog.
Ovisnost valencije o strukturi atoma
Razmotrimo, na primjeru ugljika i kisika, kako valencija kemijskih elemenata ovisi o strukturi tvari. Periodni sustav daje ideju o glavnim karakteristikama atoma ugljika:
- kemijski znak - C;
- broj stavke - 6;
- napunjenost jezgre - +6;
- protoni u jezgri - 6;
- elektrona - 6, uključujući 4 vanjska, od kojih 2 čine par, 2 - nespareni.
Ako ugljikov atom u CO monoksidu tvori dvaveze, tada u njegovu upotrebu dolazi samo 6 negativnih čestica. Za dobivanje okteta, parovi moraju formirati 4 vanjske negativne čestice. Ugljik ima valenciju IV (+) u dioksidu i IV (-) u metanu.
Redni broj kisika - 8, valencijaljuska se sastoji od šest elektrona, od kojih 2 ne tvore parove i sudjeluju u kemijskoj vezi i interakciji s drugim atomima. Tipična valencija kisika je II (-).

Valencija i oksidacijsko stanje
U mnogim je slučajevima prikladnije za korištenjekoncept "oksidacijskog stanja". To je naziv naboja atoma, koji bi stekao kada bi se svi vezani elektroni prenijeli na element koji ima veću vrijednost elektronegativnosti (EO). Oksidacijski broj u jednostavnoj tvari je nula. Znak "-" dodaje se oksidacijskom stanju više od EO elementa, znak "+" dodaje se manje elektronegativnom stanju. Na primjer, za metale glavnih podskupina tipična su oksidacijska stanja i naboji iona jednaki broju skupine sa znakom "+". U većini slučajeva, valencija i oksidacijsko stanje atoma u istom spoju numerički su isti. Samo pri interakciji s više elektronegativnih atoma oksidacijsko stanje je pozitivno, s elementima s nižim EO – negativno. Koncept "valencije" često se primjenjuje samo na tvari molekularne strukture.







