Proteini su jedan od važnih organskih elemenatabilo koja živa stanica tijela. Obavljaju mnoge funkcije: potporne, signalne, enzimske, transportne, strukturne, receptorske itd. Primarne, sekundarne, tercijarne i kvartarne strukture proteina postale su važna evolucijska prilagodba. Od čega su napravljene ove molekule? Zašto je ispravna konformacija proteina u stanicama tijela toliko važna?
Strukturne komponente proteina
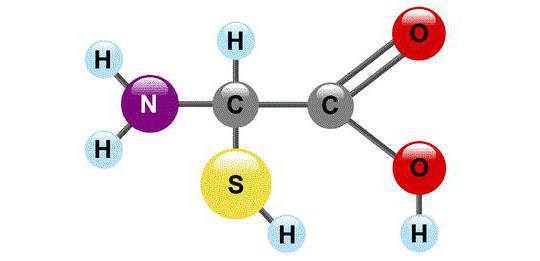
Monomeri bilo kojeg polipeptidnog lanca suaminokiseline (AA). Ovi organski spojevi male molekularne težine prilično su česti u prirodi i mogu postojati kao neovisne molekule koje obavljaju svoje inherentne funkcije. Među njima je transport tvari, primanje, inhibicija ili aktivacija enzima.
Ukupno ima oko 200 biogenihaminokiseline, međutim, samo 20 od njih mogu biti proteinski monomeri. Lako se otapaju u vodi, kristalne su strukture i mnoge od njih su slatkastog okusa.

S kemijskog gledišta, AK su molekule ukoje nužno sadrže dvije funkcionalne skupine: -COOH i -NH2. Uz pomoć ovih skupina, aminokiseline tvore lance, povezujući se međusobno peptidnom vezom.
Svaka od 20 proteinogenih aminokiselina ima svoj radikal, ovisno o tome koja se kemijska svojstva razlikuju. Prema sastavu takvih radikala, svi AA su razvrstani u nekoliko skupina.
- Nepolarni: izoleucin, glicin, leucin, valin, prolin, alanin.
- Polarni i nenabijeni: treonin, metionin, cistein, serin, glutamin, asparagin.
- Aromatični: tirozin, fenilalanin, triptofan.
- Polarni i negativno nabijeni: glutamat, aspartat.
- Polarni i pozitivno nabijeni: arginin, histidin, lizin.
Bilo koja razina organizacije strukture proteina(primarni, sekundarni, tercijarni, kvarterni) temelji se na polipeptidnom lancu koji se sastoji od AA. Jedina razlika je kako se taj slijed formira u prostoru i pomoću kojih se kemijskih veza održava takva konformacija.
Primarna struktura proteina
Svaki protein nastaje na ribosomima -nemembranske stanične organele koje sudjeluju u sintezi polipeptidnog lanca. Ovdje su aminokiseline međusobno povezane snažnom peptidnom vezom, tvoreći primarnu strukturu. Međutim, ova primarna struktura proteina izrazito se razlikuje od kvartarne, pa je potrebno daljnje sazrijevanje molekule.
Proteini poput elastina, histona, glutationa već sus tako jednostavnom strukturom, sposobni su obavljati svoje funkcije u tijelu. Za veliku većinu proteina, sljedeća faza je stvaranje složenije sekundarne konformacije.

Sekundarna struktura proteina
Stvaranje peptidnih veza je prva fazasazrijevanje većine proteina. Kako bi mogli obavljati svoje funkcije, njihova lokalna konformacija mora doživjeti neke promjene. To se postiže uz pomoć vodikovih veza – krhkih, ali ujedno i brojnih veza između bazičnih i kiselih središta molekula aminokiselina.
Tako nastaje sekundarna struktura proteina, odkvartar koji karakterizira jednostavnost sklapanja i lokalna konformacija. Potonje znači da se cijeli lanac ne transformira. Vodikove veze mogu nastati na više mjesta na različitim međusobno udaljenim, a njihov oblik ovisi i o vrsti aminokiselina i načinu sklapanja.
Lizozim i pepsin su predstavnici proteina,ima sekundarnu strukturu. Pepsin je uključen u procese probave, a lizozim obavlja zaštitnu funkciju u tijelu, uništavajući stanične stijenke bakterija.

Značajke sekundarne strukture
Lokalne konformacije peptidnog lanca moguvarirati. Proučeno ih je već nekoliko desetaka, a tri su najčešća. To uključuje alfa spiralu, beta slojeve i beta rotaciju.
- Alfa spirala je jedna od najčešćih konformacija sekundarne strukture u većini proteina. To je kruti okvir štapa s hodom od 0,54 nm. Radikali aminokiselina usmjereni su prema van.
Najčešće su desnoruke spirale,a ponekad se mogu naći i ljevoruki pandani. Funkciju tvorbe oblika obavljaju vodikove veze, koje stabiliziraju kovrče. Lanac koji tvori alfa spiralu sadrži vrlo malo prolina i polarno nabijenih aminokiselina.
- Beta zaokret je izoliran u zasebnu konformaciju,iako se može nazvati dijelom beta sloja. Suština leži u zavoju peptidnog lanca, koji je podržan vodikovim vezama. Obično se mjesto samog zavoja sastoji od 4-5 aminokiselina, među kojima je potrebna prisutnost prolina. Ovaj AK jedini ima krut i kratak kostur, koji omogućuje formiranje samog okreta.
- Beta sloj je lanac aminokiselinakoji tvori nekoliko zavoja i stabilizira ih vodikovim vezama. Ova konformacija je vrlo slična listu papira presavijenog u harmoniku. Najčešće, agresivni proteini imaju ovaj oblik, ali postoje mnoge iznimke.
Razlikovati paralelni i antiparalelni beta sloj. U prvom slučaju, C- i N-kraj na mjestima savijanja i na krajevima lanca podudaraju se, au drugom slučaju ne.
Tercijarna struktura
Daljnje pakiranje proteina dovodi do stvaranjatercijarna struktura. Ovu konformaciju stabiliziraju vodikove, disulfidne, hidrofobne i ionske veze. Njihov veliki broj omogućuje da se sekundarna struktura uvije u složeniji oblik i stabilizira.
Odvojite globularne i fibrilarne proteine. Molekula globularnih peptida je sferne strukture. Primjeri: albumin, globulin, histoni u tercijarnoj strukturi.
Vlaknasti proteini tvore jake niti, dužinešto prelazi njihovu širinu. Takvi proteini najčešće obavljaju strukturne i formativne funkcije. Primjeri su fibroin, keratin, kolagen, elastin.

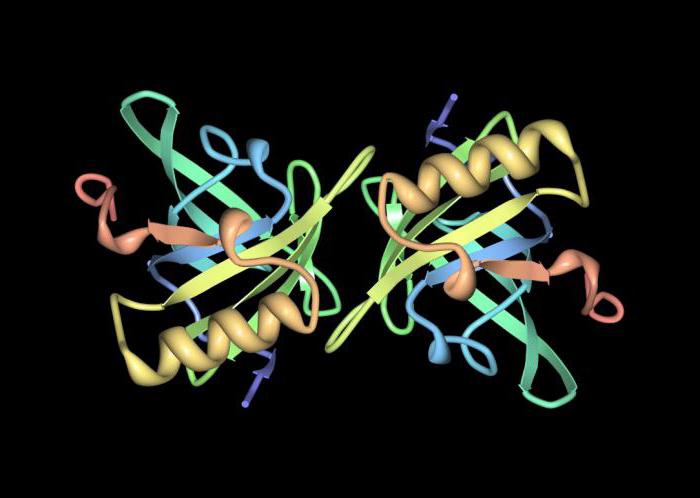
Struktura proteina u kvartarnoj strukturi molekule
Ako se više globula spoji u jednukompleksa, formira se tzv. kvartarna struktura. Ova konformacija nije tipična za sve peptide, a nastaje kada je potrebno obavljati važne i specifične funkcije.
Svaka globula u kompleksnom proteinu je zasebna domena ili protomer. Zajedno, struktura proteina kvartarne strukture molekule naziva se oligomer.
Obično, takav protein ima nekoliko stabilnihkonformacije koje se međusobno stalno zamjenjuju, bilo ovisno o utjecaju bilo kakvih vanjskih čimbenika, bilo kada je potrebno obavljati različite funkcije.
Važna razlika između tercijarne strukture proteina ikvartarne su intermolekularne veze, koje su odgovorne za povezivanje nekoliko globula. U središtu cijele molekule često se nalazi ion metala koji izravno utječe na stvaranje međumolekulskih veza.
Dodatne strukture proteina
Lanac aminokiselina nije uvijek dovoljan zaobavljajući funkcije proteina. U većini slučajeva na takve su molekule vezane druge tvari organske i anorganske prirode. Budući da je ova značajka karakteristična za ogroman broj enzima, sastav složenih proteina obično se dijeli na tri dijela:
- Apoenzim je proteinski dio molekule, koji je sekvenca aminokiselina.
- Koenzim nije protein, već organski dio.Može uključivati različite vrste lipida, ugljikohidrata ili čak nukleinskih kiselina. To uključuje predstavnike biološki aktivnih spojeva, među kojima su i vitamini.
- Kofaktor je anorganski dio, predstavljen u velikoj većini slučajeva metalnim ionima.
Struktura proteina u kvartarnoj strukturimolekula zahtijeva sudjelovanje nekoliko molekula različitog podrijetla, pa mnogi enzimi imaju tri komponente odjednom. Primjer je fosfokinaza, enzim koji prenosi fosfatnu skupinu s molekule ATP-a.
Gdje nastaje kvartarna struktura proteinske molekule?
Polipeptidni lanac počinje se sintetizirati naribosoma stanice, međutim, daljnje sazrijevanje proteina događa se već u drugim organelama. Novonastala molekula mora ući u transportni sustav koji se sastoji od nuklearne membrane, EPS-a, Golgijevog aparata i lizosoma.
Komplikacija prostorne strukture proteinajavlja se u endoplazmatskom retikulumu, gdje se ne stvaraju samo razne vrste veza (vodikove, disulfidne, hidrofobne, intermolekularne, ionske), već se vežu i koenzim i kofaktor. Tako nastaje kvartarna struktura proteina.
Kada je molekula potpuno spremna za rad, onaulazi ili u citoplazmu stanice ili u Golgijev aparat. U potonjem slučaju, ovi peptidi se pakiraju u lizosome i transportiraju u druge odjeljke stanica.
Primjeri oligomernih proteina
Kvartarna struktura je struktura proteina,koji je osmišljen da olakša obavljanje vitalnih funkcija u živom organizmu. Složena konformacija organskih molekula omogućuje, prije svega, utjecaj na rad mnogih metaboličkih procesa (enzima).
Biološki važni proteini su hemoglobin, klorofil i hemocijanin. Porfirinski prsten je osnova ovih molekula, u čijem je središtu metalni ion.
hemoglobin
Kvartarna struktura proteinske molekule hemoglobinapredstavlja 4 globule povezane intermolekularnim vezama. U središtu - porfin s ionom željeza. Protein se transportira u citoplazmi eritrocita, gdje zauzima oko 80% ukupnog volumena citoplazme.
Osnova molekule je hem, koji je više anorganske prirode i obojen je crvenom bojom. Također je primarni proizvod razgradnje hemoglobina u jetri.
Svi znamo da hemoglobin ima važnu ulogutransportna funkcija – prijenos kisika i ugljičnog dioksida kroz ljudsko tijelo. Složena konformacija proteinske molekule tvori posebne aktivne centre, koji su sposobni vezati odgovarajuće plinove s hemoglobinom.
Kada se formira kompleks proteina i plina,nastaju takozvani oksihemoglobin i karbohemoglobin. Međutim, postoji još jedna vrsta takvih asocijacija koja je prilično stabilna: karboksihemoglobin. To je kompleks proteina i ugljičnog monoksida, čija stabilnost objašnjava napade gušenja s prekomjernom toksičnošću.

Klorofil
Još jedan predstavnik proteina s kvartarnom strukturom, čije su veze domena već podržane magnezijevim ionom. Glavna funkcija cijele molekule je sudjelovanje u procesima fotosinteze u biljkama.
Postoje različite vrste klorofila kojimeđusobno se razlikuju po radikalima porfirinskog prstena. Svaka od ovih sorti označena je posebnim slovom latinske abecede. Primjerice, kopnene biljke karakterizira prisutnost klorofila a ili klorofila b, dok se druge vrste ovog proteina nalaze u algama.

hemocijanin
Ova molekula je analog hemoglobina u mnogim nižimživotinje (člankonošci, mekušci itd.). Glavna razlika u strukturi proteina s kvaternarnom molekularnom strukturom je prisutnost iona cinka umjesto iona željeza. Hemocijanin je plavkaste boje.
Ponekad se ljudi pitaju što bi to biloako ljudski hemoglobin zamijenite hemocijaninom. U tom slučaju je poremećen uobičajeni sadržaj tvari u krvi, osobito aminokiselina. Hemocijanin također nestabilno stvara kompleks s ugljičnim dioksidom, pa bi "plava krv" imala sklonost stvaranju krvnih ugrušaka.