Najjednostavniji organski spojevi su zasićeni i nezasićeni ugljikovodici. Tu spadaju tvari klase alkana, alkini, alkeni.
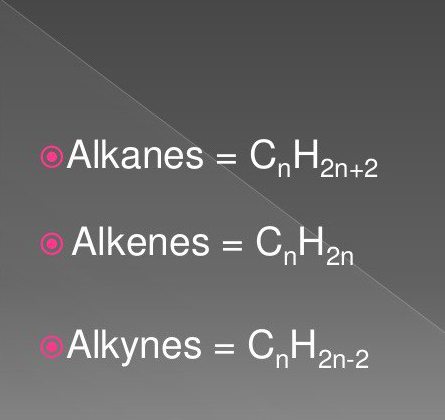
Njihove formule uključuju atome vodika i ugljika u određenom slijedu i količini. U prirodi su česte.
Određivanje alkena
Njihovo drugo ime su olefini ili etilen ugljikovodici. Tako se nazivala ova klasa spojeva u 18. stoljeću kada je otkrivena uljna tekućina - etilenklorid.
Alkeni uključuju tvari koje se sastoje odelementi vodika i ugljika. Klasificirani su kao aciklički ugljikovodici. Njihova molekula sadrži jednostruku dvostruku (nezasićenu) vezu koja međusobno povezuje dva atoma ugljika.
Formule alkena
Svaka klasa spojeva ima svoju kemijsku oznaku. U njima simboli elemenata periodičnog sustava ukazuju na sastav i strukturu veze svake tvari.

Opća formula za alkene naznačena je kako slijedi: CnX2n, gdje je broj n veći ili jednak 2. Kad se dešifrira, može se vidjeti da za svaki atom ugljika postoje dva atoma vodika.
Molekularne formule homolognih alkena predstavljene su sljedećim strukturama: C2X4, C3X6, IZ4X8, C5X10, C6X12, C7X14, C8X16, C9X18, C10X20... Vidi se da svaki sljedeći ugljikovodik sadrži još jedan ugljik i još 2 vodika.
Postoji grafička oznaka mjesta i redoslijeda kemijskih spojeva između atoma u molekuli, koja prikazuje strukturnu formulu alkena. Uz pomoć valentnih crtica naznačena je veza ugljika s vodikovima.
Može se prikazati strukturna formula alkenau proširenom obliku, kada su prikazani svi kemijski elementi i veze. Sažetiji izraz za olefine ne pokazuje spoj ugljika i vodika pomoću valentnih crtica.
Kostna formula označava najjednostavniju strukturu. Izlomljena linija predstavlja bazu molekule u kojoj su atomi ugljika predstavljeni njezinim vrhovima i krajevima, a veze označavaju vodik.
Kako nastaju olefinski nazivi
Na temelju sustavne nomenklature, formulaalkeni i njihova imena su sastavljeni od strukture alkana povezanih sa zasićenim ugljikovodicima. Da biste to učinili, u imenu potonjeg sufiks -an zamjenjuje se s -ilen ili -en. Primjer je stvaranje butilena iz butana i pentena iz pentana.
Da biste označili položaj dvostruke veze u odnosu na atome ugljika, na kraju naziva označite arapskim brojem.
Naziv alkena temelji se na notacijinajduži lanac ugljikovodika koji sadrži dvostruku vezu. Za početak brojanja lanca obično se bira kraj koji je najbliži nezasićenom spoju ugljikovih atoma.
Ako strukturna formula alkena imagrane, zatim naznačite imena radikala i njihov broj, a ispred njih se postavljaju brojevi koji odgovaraju mjestu u ugljikovom lancu. Nakon toga slijedi naziv samog ugljikovodika. Brojeve obično slijedi crtica.
Postoje nezasićene radikalne grane. Njihova imena mogu biti trivijalna ili su oblikovana prema pravilima sustavne nomenklature.
Na primjer, HNC = CH- naziva se etenil ili vinil.
Izomeri
Molekularne formule alkena ne mogu ukazivati na izomeriju. Međutim, za ovu klasu tvari, osim molekule etilena, svojstvena je prostorna modifikacija.

Izomeri etilen ugljikovodika mogu biti ugljikov kostur, položaj nezasićenih veza, međurazred ili prostor.
Opća formula alkena određuje količinuatoma ugljika i vodika u lancu, ali on ne pokazuje prisutnost i mjesto dvostruke veze. Primjer je ciklopropan kao međurazredni izomer C3X6 (propilen). Ostale vrste izomerije pojavljuju se u C4X8 ili buten.
Drugačiji položaj nezasićene veze uočava se ubuten-1 ili buten-2, u prvom se slučaju dvostruki spoj nalazi u blizini prvog atoma ugljika, a u drugom - u sredini lanca. Izomerija ugljičnog kostura može se razmotriti upotrebom metilpropena (CH3-C (CH3) = CH2) i izobutilen ((CH3) 2C = CH2).
Prostorna modifikacija svojstvena je butenu-2 utrans i cis položaj. U prvom su slučaju bočni radikali smješteni iznad i ispod glavnog ugljičnog lanca s dvostrukom vezom, u drugom izomeru supstituenti su s jedne strane.
Karakterizacija olefina
Opća formula alkena određuje fizičko stanje svih predstavnika ove klase. Počevši od etilena i završavajući butilenom (od C2 do C4), tvari postoje u plinovitom obliku. Dakle, bezbojni eten ima slatkast miris, nisku topljivost u vodi, a molekulska masa manja je od mase zraka.
U tekućem obliku, ugljikovodici homolognog intervala iz C5 do C17... Počevši od alkena, koji ima 18 atoma ugljika u glavnom lancu, događa se prijelaz fizičkog stanja u čvrsti oblik.
Smatra se da su svi olefini slabo topljivi uvodeni okoliš, ali dobar u organskim otapalima, poput benzena ili benzina. Njihova je molekularna težina manja od vode. Povećanje ugljikovog lanca dovodi do povećanja temperaturnih pokazatelja tijekom topljenja i ključanja ovih spojeva.
Svojstva olefina
Strukturna formula alkena pokazuje prisutnost ukostur dvostruke veze π- i σ- spojeva dvaju atoma ugljika. Ovakva struktura molekule određuje njezina kemijska svojstva. Smatra se da π-veza nije jako čvrsta, što je omogućuje uništavanjem stvaranjem dvije nove σ-veze, koje se dobivaju kao rezultat vezivanja para atoma. Nezasićeni ugljikovodici su elektronički donatori. Sudjeluju u postupcima elektrofilnog vezanja.
Važno kemijsko svojstvo svih alkena jepostupak halogeniranja s oslobađanjem spojeva poput dihalogeniranih tvari. Atomi halogena sposobni su dvostruko se vezati za ugljik. Primjer je bromiranje propilena u 1,2-dibromopropan:
X2C = CH - CH3 + Br2 → BrCH2–CHBr - CH3.
Ovaj postupak neutralizacije boje u vodi broma s alkenima smatra se kvalitativnim dokazom prisutnosti dvostruke veze.
Važne reakcije uključuju hidrogeniranje olifinas dodatkom molekule vodika pod djelovanjem katalitičkih metala poput platine, paladija ili nikla. Rezultat su ugljikovodici sa zasićenom vezom. Formule za alkane i alkene dane su u nastavku u reakciji hidrogenizacije butena:
B3-CH2–CH = CH2 + H2 Ni→ CH3-CH2-CH2-CH3.
Poziva se postupak vezanja molekule vodikovog halogenida na olefine
hidrohalogeniranje, prolazi prema pravilu,otkrio Markovnikov. Primjer je hidrobromiranje propilena u 2-bromopropan. U njemu se vodik kombinira dvostrukom vezom s ugljikom, koji se smatra najhidrogeniranijim:
B3–CH = CH2 + HBr → CH3–BrCH - CH3.
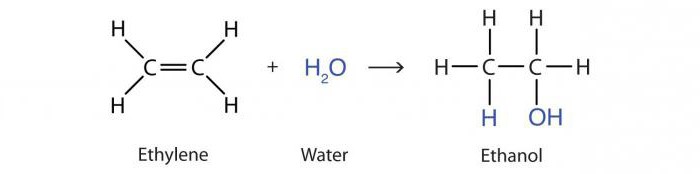
Reakcija dodavanja vode alkenima pod djelovanjem kiselina naziva se hidratacija. Rezultat je molekula alkohola propanol-2:
B3–HC = CH2 + H2O → CH3–OHCH - CH3.
Kada su alkeni izloženi sumpornoj kiselini, dolazi do procesa sulfoniranja:
B3–HC = CH2 + HO - OSO - OH → CH3-CH3CH - O - TAKO2-OH.
Reakcija se odvija stvaranjem kiselih estera, na primjer, izopropil-sumporne kiseline.
Alkeni su izloženi oksidaciji tijekom izgaranja pod djelovanjem kisika uz stvaranje vode i plina ugljičnog dioksida:
2CH3–HC = CH2 + 9O2 → 6CO2 + 6H2O.
Interakcija olefinskih spojeva irazrijeđeni kalij permanganat u obliku otopine dovodi do stvaranja glikola ili dvoatomskih alkohola. Ova reakcija je također oksidativna s nastankom etilen glikola i promjenom boje otopine:
3H2C = CH2 + 4H2O + 2KMnO4 → 3OHCH - CHOH + 2MnO2 + 2KOH.
Molekule alkena mogu biti uključene u polimerizaciju sa slobodnim radikalima ili kationsko-anionskim mehanizmom. U prvom slučaju, pod utjecajem peroksida, dobiva se polimer tipa polietilena.
Prema drugom mehanizmu, kiseline djeluju kao kationski katalizatori, a organometalne tvari su anionske s oslobađanjem stereoselektivnog polimera.
Što su alkani
Oni se također nazivaju parafini ili ograničavajućiaciklički ugljikovodici. Imaju linearnu ili razgranatu strukturu koja sadrži samo zasićene jednostavne veze. Svi predstavnici homolognih nizova ove klase imaju opću formulu CnX2n + 2.
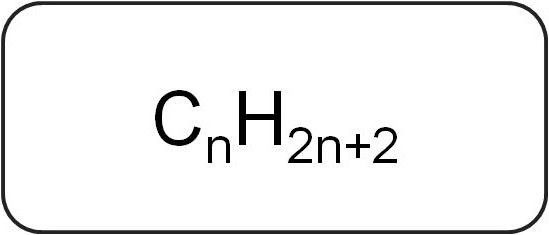
Sadrže samo atome ugljika i vodika. Opća formula za alkene izvedena je iz zapisa zasićenih ugljikovodika.
Imena alkana i njihove karakteristike
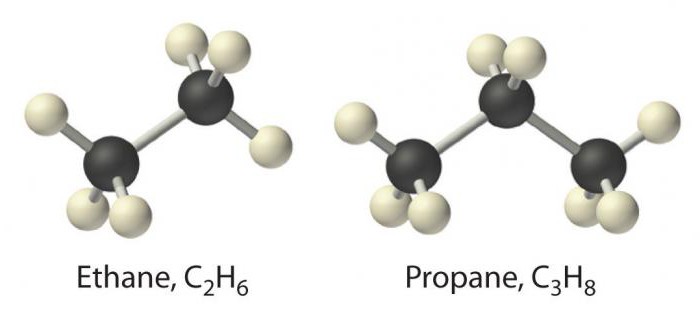
Najjednostavniji predstavnik ove klaseje metan. Slijede tvari kao što su etan, propan i butan. Njihovo se ime temelji na korijenu broja na grčkom, kojemu je dodan sufiks -an. Imena alkana navedena su u IUPAC nomenklaturi.
Opća formula za alkene, alkine, alkane uključujesamo dvije vrste atoma. Tu spadaju elementi ugljik i vodik. Broj atoma ugljika u sve tri klase je jednak, razlika se uočava samo u broju vodika koji se može odvojiti ili spojiti. Nezasićeni spojevi dobivaju se iz zasićenih ugljikovodika. Predstavnici parafina u molekuli sadrže 2 atoma vodika više od olefina, što potvrđuje opća formula alkana, alkena. Smatra se da je alkenska struktura nezasićena zbog prisutnosti dvostruke veze.
Ako povežemo broj atoma vodika i ugljika u alkanima, tada će vrijednost biti maksimalna u usporedbi s ostalim razredima ugljikovodika.
Počevši od metana i završavajući butanom (od C1 do C4), tvari postoje u plinovitom obliku.
U tekućem obliku, ugljikovodici homolognog intervala iz C5 do C16... Počevši od alkana koji ima 17 atoma ugljika u glavnom lancu, dolazi do prijelaza fizičkog stanja u čvrsti oblik.
Karakterizira ih izomerija u ugljikovom skeletu i optičke modifikacije molekule.
U parafinu se uzimaju u obzir valencije ugljikau potpunosti zauzimaju susjedni ugljikovi ili vodikovi da tvore vezu tipa σ. S kemijskog gledišta to uzrokuje njihova slaba svojstva, zbog čega se alkani nazivaju zasićenim ili zasićenim ugljikovodicima, lišenim afiniteta.
Ulaze u reakcije supstitucije povezane s radikalnim halogeniranjem, sulfokloriranjem ili nitriranjem molekule.
Parafini se podvrgavaju oksidaciji, izgaranju ili razgradnji na visokim temperaturama. Pod djelovanjem akceleratora reakcije dolazi do eliminacije atoma vodika ili dehidrogenacije alkana.
Što su alkini
Oni se nazivaju i acetilenski ugljikovodici, koji imaju trostruku vezu u ugljikovom lancu. Struktura alkina opisana je općom formulom CnX2n - 2... To pokazuje da, za razliku od alkana, acetilenskim ugljikovodicima nedostaju četiri atoma vodika. Zamjenjuju se trostrukom vezom koju tvore dva π-spoja.
Ova struktura određuje kemijska svojstva ove klase. Strukturna formula alkena i alkina jasno pokazuje nezasićenost njihovih molekula, kao i prisutnost dvostrukog (H2C꞊CH2) i trostruke (HC≡CH) veze.
Naziv alkina i njihove karakteristike
Najjednostavniji predstavnik je acetilenili HC≡CH. Također se naziva etin. Dolazi od naziva zasićenog ugljikovodika, u kojem se uklanja sufiks -an i dodaje -in. U imenima dugih alkina, broj označava mjesto trostruke veze.
Poznavajući strukturu zasićenih ugljikovodika inezasićeni, moguće je utvrditi pod kojim je slovom označena opća formula alkina: a) CnH2n; c) CnH2n + 2; c) CnH2n-2; d) CnH2n-6. Treća opcija je točan odgovor.
Počevši od acetilena i završavajući butanom (od C2 do C4), tvari su plinovite prirode.

U tekućem obliku nalaze se ugljikovodici homolognog intervala od C5 do C17... Počevši od alkina, koji ima 18 atoma ugljika u glavnom lancu, dolazi do prijelaza fizičkog stanja u čvrsti oblik.
Karakterizira ih izomerija u ugljikovom kosturu, u položaju trostruke veze, kao i u interklasnim modifikacijama molekule.
Po kemijskim svojstvima acetilenski ugljikovodici slični su alkenima.
Ako alkini imaju terminalnu trostruku vezu, onda onidjeluju kao kiselina da bi stvorili alkidne soli, na primjer NaC≡CNa. Prisutnost dvije π-veze čini molekulu natrijevog acetiledina snažnim nukleofilom koji ulazi u reakcije supstitucije.
Acetilen se podvrgava kloriranju u prisutnosti bakrenog klorida dajući dikloracetilen, kondenzirajući se pod djelovanjem haloalkina uz oslobađanje molekula diacetilena.
Alkini su uključeni u reakcije adicijeelektrofilni, čiji je princip osnova halogeniranja, hidrohalogeniranja, hidratacije i karbonilacije. Međutim, takvi su procesi slabiji od procesa alkena s dvostrukom vezom.
Za acetilenske ugljikovodike moguće su nukleofilne reakcije dodavanja molekula alkohola, primarnog amina ili sumporovodika.








