Alle Körper, die uns umgeben, bestehen aus Atomen. Die Atome bilden wiederum ein Molekül. Aufgrund der unterschiedlichen Molekülstruktur können wir über Substanzen sprechen, die sich aufgrund ihrer Eigenschaften und Parameter voneinander unterscheiden. Moleküle und Atome sind immer in einem dynamischen Zustand. Wenn sie sich bewegen, streuen sie immer noch nicht in verschiedene Richtungen, sondern werden in einer bestimmten Struktur gehalten, was wir der Existenz einer so großen Vielfalt von Substanzen in der ganzen Welt um uns herum verdanken. Was sind diese Partikel und welche Eigenschaften haben sie?
Allgemeine Konzepte
Wenn wir von der Theorie der Quantenmechanik ausgehen, dann besteht das Molekül nicht aus Atomen, sondern aus ihren Kernen und Elektronen, die ständig miteinander interagieren.
Bei einigen Substanzen ist das Molekül das kleinsteein Partikel, das die Zusammensetzung und die chemischen Eigenschaften des Stoffes selbst aufweist. Die Eigenschaften von Molekülen aus chemischer Sicht werden also durch ihre chemische Struktur und Zusammensetzung bestimmt. Aber nur für Substanzen mit molekularer Struktur gilt die Regel: Die chemischen Eigenschaften von Substanzen und Molekülen sind gleich. Für einige Polymere wie Ethylen und Polyethylen ist die Zusammensetzung nicht molekular.
Es ist bekannt, dass die Eigenschaften von Molekülen nicht bestimmt werdennur die Anzahl der Atome, ihre Art, aber auch die Konfiguration, die Reihenfolge der Verbindung. Ein Molekül ist eine komplexe architektonische Struktur, in der jedes Element an seiner Stelle steht und seine eigenen spezifischen Nachbarn hat. Die Atomstruktur kann mehr oder weniger starr sein. Jedes Atom schwingt um seine Gleichgewichtsposition.

Konfiguration und Parameter
Es kommt vor, dass sich einige Teile eines Moleküls im Verhältnis zu anderen Teilen drehen. Während der thermischen Bewegung nimmt ein freies Molekül bizarre Formen (Konfigurationen) an.
Grundsätzlich werden die Eigenschaften von Molekülen durch die Bindung bestimmt(sein Typ) zwischen Atomen und der Architektur des Moleküls selbst (Struktur, Form). Die allgemeine chemische Theorie berücksichtigt also zunächst chemische Bindungen und basiert auf den Eigenschaften von Atomen.
Mit einer stark ausgeprägten Polarität sind die Eigenschaften von Molekülenschwer zu beschreiben mit zwei oder drei konstanten Korrelationen, die für unpolare Moleküle großartig sind. Daher wurde ein zusätzlicher Parameter mit einem Dipolmoment eingeführt. Diese Methode ist jedoch nicht immer erfolgreich, da polare Moleküle individuelle Eigenschaften haben. Es wurden auch Parameter vorgeschlagen, um Quanteneffekte zu berücksichtigen, die bei niedrigen Temperaturen wichtig sind.
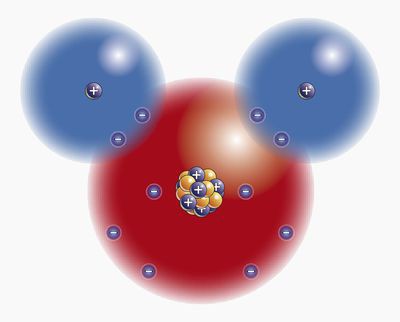
Was wissen wir über das Molekül der am häufigsten vorkommenden Substanz auf der Erde?
Von allen Substanzen auf unserem Planeten die meistenhäufig ist Wasser. Sie bietet im wahrsten Sinne des Wortes Leben für alles auf der Erde. Nur Viren können darauf verzichten, der Rest der lebenden Strukturen in ihrer Zusammensetzung hat meist Wasser. Welche nur charakteristischen Eigenschaften eines Wassermoleküls werden im Wirtschaftsleben des Menschen und in der lebendigen Natur der Erde genutzt?
Immerhin ist dies eine wirklich einzigartige Substanz! Keine andere Substanz kann eine Reihe von Eigenschaften aufweisen, die Wasser innewohnen.
Wasser ist das Hauptlösungsmittel in der Natur. Alle Reaktionen, die in lebenden Organismen auf die eine oder andere Weise auftreten, finden in Gewässern statt. Das heißt, Substanzen reagieren in gelöstem Zustand.
Wasser hat eine ausgezeichnete Wärmekapazität, ist aber niedrigWärmeleitfähigkeit. Dank dieser Eigenschaften können wir es als Wärmetransport nutzen. Dieses Prinzip ist im Kühlmechanismus einer großen Anzahl von Organismen enthalten. In der Kernkrafttechnik führten die Eigenschaften des Wassermoleküls zur Verwendung dieser Substanz als Wärmeträger. Zusätzlich zu der Fähigkeit, ein reaktives Medium für andere Substanzen zu sein, kann Wasser selbst Reaktionen eingehen: Photolyse, Hydratation und andere.

Natürlich sauberes Wasser ist eine Flüssigkeit, die geruchlos, farblos und geschmacklos ist. Bei einer Schichtdicke von mehr als 2 Metern wird die Farbe jedoch bläulich.
Das gesamte Wassermolekül ist ein Dipol (zwei entgegengesetzte Pole). Es ist die Dipolstruktur, die hauptsächlich die ungewöhnlichen Eigenschaften dieser Substanz bestimmt. Ein Wassermolekül ist ein Diamagnet.
Eine weitere interessante Eigenschaft ist geschmolzenWasser: Sein Molekül erhält die Struktur des Goldenen Schnitts und die Struktur der Substanz die Proportionen des Goldenen Schnitts. Viele der Eigenschaften, die ein Wassermolekül besitzt, wurden durch Analyse der Absorption und Emission von Streifenspektren in der Gasphase ermittelt.
Naturgeschichte und molekulare Eigenschaften
Alle Substanzen außer den chemischen haben die physikalischen Eigenschaften der in ihrer Struktur enthaltenen Moleküle.
In der Physik wird das Konzept der Moleküle verwendetErklärungen der Eigenschaften von Feststoffen, Flüssigkeiten und Gasen. Die Diffusionsfähigkeit aller Substanzen, ihre Viskosität, Wärmeleitfähigkeit und andere Eigenschaften werden durch die Mobilität der Moleküle bestimmt. Als der französische Physiker Jean Perrin die Brownsche Bewegung studierte, bewies er experimentell die Existenz von Molekülen. Alle lebenden Organismen existieren aufgrund einer fein ausbalancierten inneren Interaktion in der Struktur. Alle chemischen und physikalischen Eigenschaften von Substanzen sind für die Naturwissenschaften von grundlegender Bedeutung. Die Entwicklung der Physik, Chemie, Biologie und Molekularphysik führte zu einer Wissenschaft wie der Molekularbiologie, die die grundlegenden Phänomene im Leben untersucht.
Mit statistischer Thermodynamik,Die physikalischen Eigenschaften von Molekülen, die durch molekularspektroskopische Methoden bestimmt werden, in der physikalischen Chemie bestimmen die thermodynamischen Eigenschaften von Substanzen, die zur Berechnung chemischer Gleichgewichte erforderlich sind, und die Geschwindigkeit ihrer Etablierung.
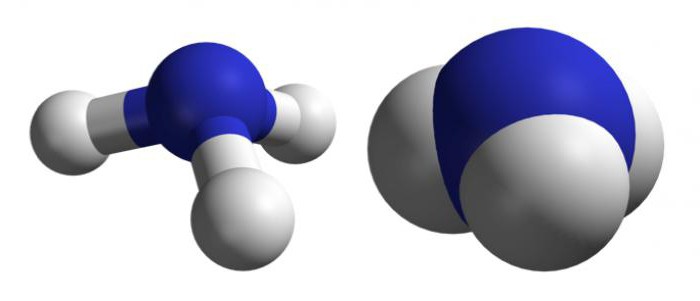
Wie unterscheiden sich die Eigenschaften von Atomen und Molekülen voneinander?
Erstens treten Atome nicht in einem freien Zustand auf.
Moleküle haben reichere optische Spektren.Dies ist auf die geringere Symmetrie des Systems und die Entstehung der Möglichkeit neuer Rotationen und Vibrationen von Kernen zurückzuführen. Die Gesamtenergie eines Moleküls besteht aus drei Energien, die sich in der Größenordnung der Komponenten unterscheiden:
- elektronische Hülle (optische oder ultraviolette Strahlung);
- Schwingungen der Kerne (infraroter Teil des Spektrums);
- Rotation des gesamten Moleküls (Hochfrequenzbereich).
Atome emittieren charakteristische Linienspektren und gestreifte Moleküle, die aus vielen eng beieinander liegenden Linien bestehen.
Spektralanalyse
Optisch, elektrisch, magnetisch und andereDie Eigenschaften eines Moleküls werden auch durch die Verbindung mit Wellenfunktionen bestimmt. Die Daten über die Zustände von Molekülen und den wahrscheinlichen Übergang zwischen ihnen zeigen molekulare Spektren.
Übergänge (elektronisch) in Molekülen zeigenchemische Bindungen und die Struktur ihrer elektronischen Schalen. Spektren mit mehr Bindungen weisen langwellige Absorptionsbanden auf, die in den sichtbaren Bereich fallen. Wenn eine Substanz aus solchen Molekülen aufgebaut ist, hat sie eine charakteristische Farbe. Dies sind alles organische Farbstoffe.
Eigenschaften von Molekülen derselben Substanzsind in allen Aggregatzuständen gleich. Dies bedeutet, dass sich die Eigenschaften von Molekülen flüssiger, gasförmiger Substanzen für dieselben Substanzen nicht von den Eigenschaften eines Feststoffs unterscheiden. Ein Molekül einer Substanz hat unabhängig vom Aggregatzustand der Substanz selbst immer die gleiche Struktur.
Elektrische Eigenschaften
Wie sich eine Substanz in einem elektrischen Feld verhält, wird durch die elektrischen Eigenschaften der Moleküle bestimmt: Polarisierbarkeit und ein konstantes Dipolmoment.
Das Dipolmoment ist die elektrische Asymmetrie eines Moleküls. Moleküle mit einem Symmetriezentrum wie H.2gibt es kein permanentes Dipolmoment.Die Fähigkeit der Elektronenhülle eines Moleküls, sich unter dem Einfluss eines elektrischen Feldes zu bewegen, wodurch ein induziertes Dipolmoment darin gebildet wird, ist Polarisierbarkeit. Um den Wert der Polarisierbarkeit und des Dipolmoments zu ermitteln, muss die Dielektrizitätskonstante gemessen werden.
Verhalten in einem elektrischen WechselfeldLichtwellen charakterisieren die optischen Eigenschaften einer Substanz, die durch die Polarisierbarkeit des Moleküls dieser Substanz bestimmt werden. In direktem Zusammenhang mit der Polarisierbarkeit stehen: Streuung, Brechung, optische Aktivität und andere Phänomene der molekularen Optik.
Sie können oft die Frage hören: "Wovon hängen die Eigenschaften einer Substanz außer Molekülen ab?" Die Antwort ist ganz einfach.
Die Eigenschaften von Substanzen werden neben Isometrie und Kristallstruktur durch die Umgebungstemperatur, die Substanz selbst, den Druck und das Vorhandensein von Verunreinigungen bestimmt.

Chemie der Moleküle
Vor der Bildung einer Wissenschaft wie QuantenMechanik war die Natur der chemischen Bindungen in Molekülen ein ungelöstes Rätsel. Die klassische Physik konnte die Richtung und Sättigung von Valenzbindungen nicht erklären. Nach der Erstellung grundlegender theoretischer Informationen über die chemische Bindung (1927) am Beispiel des einfachsten H2-Moleküls begannen sich die Theorie und die Berechnungsmethoden allmählich zu verbessern. Zum Beispiel wurde es auf der Grundlage der weit verbreiteten Anwendung der Methode der Molekülorbitale, der Quantenchemie, möglich, interatomare Abstände, die Energie von Molekülen und chemischen Bindungen, die Verteilung der Elektronendichte und andere Daten zu berechnen, die vollständig mit den experimentellen übereinstimmten.
Substanzen mit der gleichen Zusammensetzung, aber unterschiedlichen chemischen Strukturen und unterschiedlichen Eigenschaften werden als Strukturisomere bezeichnet. Sie haben unterschiedliche Strukturformeln, aber die gleichen molekularen.
Es sind verschiedene Arten von Strukturisomerie bekannt.Die Unterschiede liegen in der Struktur des Kohlenstoffgerüsts, der Position der funktionellen Gruppe oder der Position der Mehrfachbindung. Darüber hinaus gibt es noch räumliche Isomere, bei denen die Eigenschaften eines Substanzmoleküls durch die gleiche Zusammensetzung und chemische Struktur gekennzeichnet sind. Daher haben sie die gleichen Struktur- und Molekülformeln. Die Unterschiede liegen in der räumlichen Form des Moleküls. Zur Darstellung verschiedener räumlicher Isomere werden spezielle Formeln verwendet.
Es gibt Verbindungen, die Homologe genannt werden.Sie sind in Struktur und Eigenschaften ähnlich, unterscheiden sich jedoch in ihrer Zusammensetzung durch eine oder mehrere CH2-Gruppen. Alle in Struktur und Eigenschaften ähnlichen Substanzen werden zu homologen Reihen zusammengefasst. Wenn man die Eigenschaften eines Homologen untersucht hat, kann man über jeden anderen argumentieren. Eine Sammlung von Homologen ist eine homologe Reihe.
Bei der Umwandlung der Strukturen eines Stoffes, chemischDie Eigenschaften von Molekülen ändern sich dramatisch. Selbst die einfachsten Verbindungen sind ein Beispiel: Methan, das sich sogar mit einem Sauerstoffatom verbindet, wird zu einer giftigen Flüssigkeit namens Methanol (Methylalkohol - CH3OH). Dementsprechend werden seine chemische Komplementarität und Wirkung auf lebende Organismen unterschiedlich. Ähnliche, aber komplexere Veränderungen treten auf, wenn die Strukturen von Biomolekülen modifiziert werden.
Die chemischen molekularen Eigenschaften sind stark abhängigaus der Struktur und den Eigenschaften von Molekülen: aus den darin enthaltenen Energiebindungen und der Geometrie des Moleküls selbst. Dies funktioniert insbesondere bei biologisch aktiven Verbindungen. Welche konkurrierende Reaktion vorherrscht, wird oft nur durch räumliche Faktoren bestimmt, die wiederum von den Ausgangsmolekülen (ihrer Konfiguration) abhängen. Ein Molekül mit einer "unbequemen" Konfiguration reagiert überhaupt nicht, während ein anderes Molekül mit derselben chemischen Zusammensetzung, aber unterschiedlicher Geometrie sofort reagieren kann.
Eine große Anzahl von biologischen Prozessenbeobachtet während des Wachstums und der Reproduktion, ist mit geometrischen Beziehungen zwischen den Reaktionsprodukten und den Ausgangssubstanzen verbunden. Zu Ihrer Information: Die Wirkung einer beträchtlichen Anzahl neuer Medikamente beruht auf einer ähnlichen Struktur von Molekülen einer Verbindung, die aus biologischer Sicht für den menschlichen Körper schädlich ist. Das Medikament ersetzt das schädliche Molekül und erschwert dessen Wirkung.
Unter Verwendung chemischer Formeln werden die Zusammensetzung undEigenschaften von Molekülen verschiedener Substanzen. Basierend auf dem Molekulargewicht und der chemischen Analyse wird das Atomverhältnis ermittelt und eine empirische Formel erstellt.
Geometrie
Bestimmung der geometrischen Struktur eines Molekülswird unter Berücksichtigung der Gleichgewichtsanordnung von Atomkernen durchgeführt. Die Wechselwirkungsenergie von Atomen hängt vom Abstand zwischen den Atomkernen ab. Bei sehr großen Entfernungen ist diese Energie Null. Wenn Atome zusammenkommen, beginnt sich eine chemische Bindung zu bilden. Dann werden die Atome stark voneinander angezogen.
Wenn es eine schwache Anziehungskraft gibt, dannDie Bildung einer chemischen Bindung ist nicht erforderlich. Wenn sich die Atome näher an nähere Entfernungen nähern, beginnen elektrostatische Abstoßungskräfte zwischen den Kernen zu wirken. Ein Hindernis für eine starke Annäherung von Atomen ist die Inkompatibilität ihrer internen elektronischen Hüllen.

Abmessungen
Es ist unmöglich, Moleküle mit bloßem Auge zu sehen.Sie sind so klein, dass selbst ein Mikroskop mit 1000-facher Vergrößerung uns nicht hilft, sie zu sehen. Biologen beobachten Bakterien mit einer Größe von 0,001 mm. Aber Moleküle sind hunderttausende Male kleiner als sie.
Heute ist die Struktur der Moleküle einer bestimmten Substanzbestimmt durch Beugungsmethoden: Neutronenbeugung, Röntgenbeugungsanalyse. Es gibt auch Schwingungsspektroskopie und elektronenparamagnetische Verfahren. Die Wahl der Methode hängt von der Art des Stoffes und seinem Zustand ab.
Die Größe eines Moleküls ist ein bedingter Wert, wennBerücksichtigen Sie die elektronische Hülle. Der Punkt liegt in der Entfernung von Elektronen von Atomkernen. Je größer sie sind, desto unwahrscheinlicher ist es, die Elektronen des Moleküls zu finden. In der Praxis kann die Größe der Moleküle unter Berücksichtigung des Gleichgewichtsabstands bestimmt werden. Dies ist die Lücke, in der sich die Moleküle selbst in enger Packung in einem Molekülkristall und in einer Flüssigkeit nähern können.
Große Entfernungen entsorgen Moleküle zuAnziehung und im Gegenteil klein zur Abstoßung. Daher hilft die Röntgenbeugungsanalyse von Molekülkristallen, die Größe des Moleküls zu bestimmen. Anhand des Diffusionskoeffizienten, der Wärmeleitfähigkeit und Viskosität von Gasen sowie der Dichte einer Substanz in kondensiertem Zustand kann die Größenordnung der Molekülgrößen bestimmt werden.






