Die einfachsten organischen Verbindungen sind gesättigte und ungesättigte Kohlenwasserstoffe. Dazu gehören Substanzen der Klasse der Alkane, Alkine, Alkene.
Ihre Formeln enthalten Wasserstoff- und Kohlenstoffatome in einer bestimmten Reihenfolge und Menge. Sie sind in der Natur verbreitet.
Bestimmung von Alkenen
Ihr anderer Name ist Olefine oder Ethylenkohlenwasserstoffe. So wurde diese Verbindungsklasse im 18. Jahrhundert genannt, als die ölige Flüssigkeit - Ethylenchlorid - entdeckt wurde.
Alkene umfassen Substanzen bestehend ausWasserstoff- und Kohlenstoffelemente. Sie werden als acyclische Kohlenwasserstoffe klassifiziert. Ihr Molekül enthält eine einfache (ungesättigte) Doppelbindung, die zwei Kohlenstoffatome miteinander verbindet.
Alkenformeln
Jede Verbindungsklasse hat ihre eigene chemische Bezeichnung. In ihnen geben die Symbole der Elemente des Periodensystems die Zusammensetzung und Struktur der Bindung jeder Substanz an.

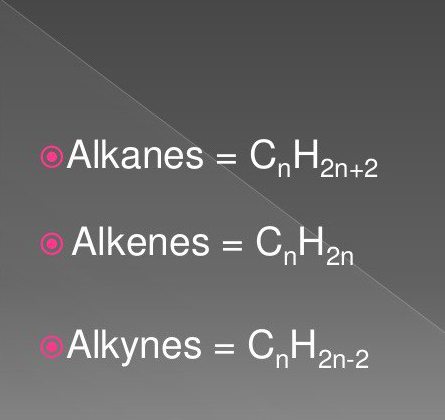
Die allgemeine Formel für Alkene ist wie folgt angegeben: C.nX2nWenn die Zahl n größer oder gleich 2 ist, kann man bei der Entschlüsselung sehen, dass es für jedes Kohlenstoffatom zwei Wasserstoffatome gibt.
Molekülformeln homologer Alkene werden durch folgende Strukturen dargestellt: C.2X4, C.3X6, C4X8, C.5X10, C.6X12, C.7X14, C.8X16, C.9X18, C.10X20... Es ist ersichtlich, dass jeder nachfolgende Kohlenwasserstoff einen weiteren Kohlenstoff und zwei weitere Wasserstoff enthält.
Es gibt eine grafische Bezeichnung für die Position und Reihenfolge chemischer Verbindungen zwischen Atomen in einem Molekül, die die Strukturformel von Alkenen zeigt. Mit Hilfe von Valenzstrichen wird die Bindung von Kohlenstoffen an Wasserstoff angezeigt.
Die Strukturformel von Alkenen kann dargestellt werdenin erweiterter Form, wenn alle chemischen Elemente und Bindungen gezeigt sind. Der präzisere Ausdruck für Olefine zeigt nicht die Verbindung von Kohlenstoff und Wasserstoff unter Verwendung von Valenzstrichen.
Die Skelettformel bezeichnet die einfachste Struktur. Die gestrichelte Linie stellt die Basis des Moleküls dar, in der die Kohlenstoffatome durch ihre Spitzen und Enden dargestellt sind, und die Verknüpfungen zeigen Wasserstoff an.
Wie Olefinnamen gebildet werden
Basierend auf der systematischen Nomenklatur wird die FormelAlkene und ihre Namen setzen sich aus der Struktur von Alkanen zusammen, die mit gesättigten Kohlenwasserstoffen verwandt sind. Zu diesem Zweck wird im Namen des letzteren das Suffix -an durch -ilen oder -en ersetzt. Ein Beispiel ist die Bildung von Butylen aus Butan und Penten aus Pentan.
Um die Position einer Doppelbindung relativ zu Kohlenstoffatomen anzuzeigen, geben Sie am Ende des Namens eine arabische Ziffer an.
Der Name der Alkene basiert auf der Notationder längste kettige Kohlenwasserstoff, der eine Doppelbindung enthält. Für den Beginn der Kettennummerierung wird üblicherweise das Ende gewählt, das der ungesättigten Verbindung der Kohlenstoffatome am nächsten liegt.
Wenn die Strukturformel von Alkenen hatZweige, geben dann die Namen der Radikale und ihre Anzahl an, und vor ihnen setzen sie Zahlen, die der Stelle in der Kohlenstoffkette entsprechen. Darauf folgt der Name des Kohlenwasserstoffs. Auf die Zahlen folgt normalerweise ein Bindestrich.
Es gibt ungesättigte Radikalverzweigungen. Ihre Namen können trivial sein oder werden nach den Regeln der systematischen Nomenklatur gebildet.
Beispielsweise wird HNC = CH- als Ethenyl oder Vinyl bezeichnet.
Isomere
Molekülformeln von Alkenen können keine Isomerie anzeigen. Für diese Substanzklasse ist jedoch mit Ausnahme des Ethylenmoleküls eine räumliche Modifikation inhärent.

Isomere von Ethylenkohlenwasserstoffen können Kohlenstoffgerüste, ungesättigte Bindungspositionen, Zwischenklassen oder räumliche sein.
Die allgemeine Formel der Alkene bestimmt die MengeKohlenstoff- und Wasserstoffatome in der Kette, aber es zeigt nicht das Vorhandensein und den Ort der Doppelbindung. Ein Beispiel ist Cyclopropan als Zwischenklassenisomer von C.3X6 (Propylen). Andere Arten von Isomerie erscheinen in C.4X8 oder Buten.
Eine andere Position der ungesättigten Verbindung wird in beobachtetButen-1 oder Buten-2, im ersten Fall befindet sich die Doppelverbindung in der Nähe des ersten Kohlenstoffatoms und im zweiten - in der Mitte der Kette. Die Kohlenstoffgerüstisomerie kann unter Verwendung von Methylpropen (CH) in Betracht gezogen werden3-C (CH3) = CH2) und Isobutylen ((CH3) 2C = CH2).
Die räumliche Modifikation ist Buten-2 in inhärenttrans und cis Position. Im ersten Fall befinden sich Seitenradikale oberhalb und unterhalb der Hauptkohlenstoffkette mit einer Doppelbindung, im zweiten Isomer befinden sich die Substituenten auf einer Seite.
Charakterisierung von Olefinen
Die allgemeine Formel der Alkene bestimmt den physischen Zustand aller Vertreter dieser Klasse. Beginnend mit Ethylen und endend mit Butylen (ab C.2 bis C.4) existieren Substanzen in gasförmiger Form. Farbloses Ethen hat also einen süßlichen Geruch, eine geringe Löslichkeit in Wasser und sein Molekulargewicht ist geringer als das von Luft.
In flüssiger Form sind Kohlenwasserstoffe des homologen Intervalls von C.5 bis C.17... Ausgehend von Alken, das 18 Kohlenstoffatome in der Hauptkette aufweist, erfolgt ein Übergang des physikalischen Zustands in eine feste Form.
Alle Olefine gelten als schlecht löslich inWasserumgebung, aber gut in organischen Lösungsmitteln wie Benzol oder Benzin. Ihr Molekulargewicht ist geringer als das von Wasser. Eine Erhöhung der Kohlenstoffkette führt zu einer Erhöhung der Temperaturindikatoren während des Schmelzens und Kochens dieser Verbindungen.
Olefin-Eigenschaften
Die Strukturformel von Alkenen zeigt das Vorhandensein indas Gerüst einer Doppelbindung von π- und σ- Verbindungen zweier Kohlenstoffatome. Diese Struktur des Moleküls bestimmt seine chemischen Eigenschaften. Die π-Bindung wird als nicht sehr stark angesehen, was es ermöglicht, sie unter Bildung von zwei neuen σ-Bindungen zu zerstören, die durch die Bindung eines Atompaares erhalten werden. Ungesättigte Kohlenwasserstoffe sind elektronische Donoren. Sie nehmen an elektrophilen Bindungsprozessen teil.
Eine wichtige chemische Eigenschaft aller Alkene istein Halogenierungsprozess unter Freisetzung von Verbindungen wie dihalogenierten Substanzen. Halogenatome können sich doppelt an Kohlenstoffe binden. Ein Beispiel ist die Bromierung von Propylen unter Bildung von 1,2-Dibrompropan:
X2C = CH - CH3 + Br2 → BrCH2–CHBr - CH3.
Dieser Prozess der Neutralisation der Farbe in Bromwasser mit Alkenen wird als qualitativer Beweis für das Vorhandensein einer Doppelbindung angesehen.
Wichtige Reaktionen umfassen die Hydrierung von Olifinenunter Zusatz eines Wasserstoffmoleküls unter Einwirkung katalytischer Metalle wie Platin, Palladium oder Nickel. Das Ergebnis sind Kohlenwasserstoffe mit einer gesättigten Bindung. Die Formeln für Alkane und Alkene sind nachstehend in der Butenhydrierungsreaktion angegeben:
H3-CH2–CH = CH2 + H.2 Ni→ CH3-CH2-CH2-CH3.
Der Prozess der Bindung eines Halogenwasserstoffmoleküls an Olefine wird genannt
Hydrohalogenierung, die gemäß der Regel verläuft,entdeckt von Markovnikov. Ein Beispiel ist die Hydrobromierung von Propylen unter Bildung von 2-Brompropan. Darin verbindet sich Wasserstoff mit einer Doppelbindung mit Kohlenstoff, der als am meisten hydriert gilt:
H3–CH = CH2 + HBr → CH3–BrCH - CH3.
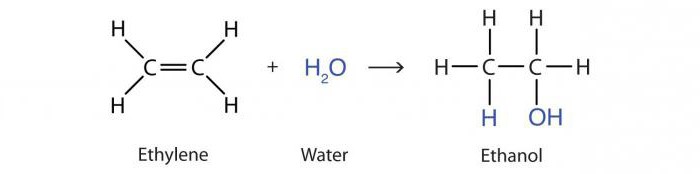
Die Reaktion der Zugabe von Wasser durch Alkene unter Einwirkung von Säuren wird als Hydratation bezeichnet. Das Ergebnis ist ein Propanol-2-Alkoholmolekül:
H3–HC = CH2 + H.2O → CH3-OHCH-CH3.
Wenn Alkene Schwefelsäure ausgesetzt werden, tritt der Sulfonierungsprozess auf:
H3–HC = CH2 + HO - OSO - OH → CH3-CH3CH - O - SO2-OH.
Die Reaktion findet unter Bildung von sauren Estern statt, beispielsweise Isopropylschwefelsäure.
Alkene neigen während ihrer Verbrennung unter Einwirkung von Sauerstoff zur Bildung von Wasser und Kohlendioxidgas zur Oxidation:
2CH3–HC = CH2 + 9O2 → 6CO2 + 6H2Ö.
Die Wechselwirkung von olefinischen Verbindungen undverdünntes Kaliumpermanganat in Form einer Lösung führt zur Bildung von Glykolen oder zweiatomigen Alkoholen. Diese Reaktion ist auch oxidativ unter Bildung von Ethylenglykol und Verfärbung der Lösung:
3H2C = CH2 + 4H2O + 2KMnO4 → 3OHCH - CHOH + 2MnO2 + 2KOH.
Alkenmoleküle können mit einem radikalischen oder kationisch-anionischen Mechanismus an der Polymerisation beteiligt sein. Im ersten Fall wird unter dem Einfluss von Peroxiden ein Polymer vom Polyethylentyp erhalten.
Nach dem zweiten Mechanismus wirken Säuren als kationische Katalysatoren, und metallorganische Substanzen sind unter Freisetzung eines stereoselektiven Polymers anionisch.
Was sind Alkane?
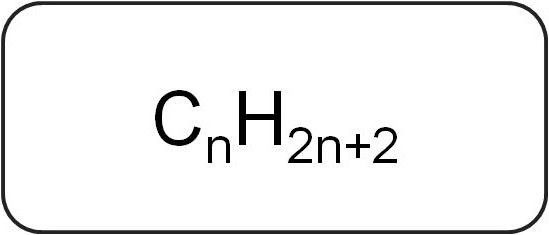
Sie werden auch als Paraffine oder limitierend bezeichnetacyclische Kohlenwasserstoffe. Sie haben eine lineare oder verzweigte Struktur, die nur gesättigte einfache Bindungen enthält. Alle Vertreter der homologen Reihen dieser Klasse haben die allgemeine Formel C.nX2n + 2.
Sie enthalten nur Kohlenstoff- und Wasserstoffatome. Die allgemeine Formel für Alkene leitet sich aus der Notation gesättigter Kohlenwasserstoffe ab.
Die Namen der Alkane und ihre Eigenschaften
Der einfachste Vertreter dieser Klasseist Methan. Es folgen Substanzen wie Ethan, Propan und Butan. Ihr Name basiert auf der Wurzel einer griechischen Zahl, zu der das Suffix -an hinzugefügt wird. Alkannamen sind in der IUPAC-Nomenklatur aufgeführt.
Die allgemeine Formel für Alkene, Alkine, Alkane umfasstnur zwei Arten von Atomen. Dazu gehören die Elemente Kohlenstoff und Wasserstoff. Die Anzahl der Kohlenstoffatome in allen drei Klassen ist gleich, der Unterschied wird nur in der Anzahl der Wasserstoffatome beobachtet, die abgespalten oder gebunden werden können. Ungesättigte Verbindungen werden aus gesättigten Kohlenwasserstoffen erhalten. Vertreter von Paraffinen im Molekül enthalten 2 mehr Wasserstoffatome als Olefine, was durch die allgemeine Formel von Alkanen, Alkenen, bestätigt wird. Die Alkenstruktur wird aufgrund des Vorhandenseins einer Doppelbindung als ungesättigt angesehen.
Wenn wir die Anzahl der Wasserstoff- und Kohlenstoffatome in Alkanen in Beziehung setzen, ist der Wert im Vergleich zu anderen Kohlenwasserstoffklassen maximal.
Beginnend mit Methan und endend mit Butan (ab C.1 bis C.4) existieren Substanzen in gasförmiger Form.
In flüssiger Form sind Kohlenwasserstoffe des homologen Intervalls von C.5 bis C.16... Ausgehend von einem Alkan mit 17 Kohlenstoffatomen in der Hauptkette erfolgt ein Übergang des physikalischen Zustands in eine feste Form.
Sie zeichnen sich durch Isomerie im Kohlenstoffgerüst und optische Modifikationen des Moleküls aus.
In Paraffinen werden Kohlenstoffvalenzen berücksichtigtvollständig von benachbarten Kohlenstoffen oder Wasserstoffatomen besetzt, um eine Bindung vom σ-Typ zu bilden. Aus chemischer Sicht verursacht dies ihre schwachen Eigenschaften, weshalb Alkane als gesättigte oder gesättigte Kohlenwasserstoffe ohne Affinität bezeichnet werden.
Sie gehen Substitutionsreaktionen ein, die mit radikalischer Halogenierung, Sulfochlorierung oder Nitrierung des Moleküls verbunden sind.
Paraffine werden bei hohen Temperaturen oxidiert, verbrannt oder zersetzt. Unter der Wirkung von Reaktionsbeschleunigern werden Wasserstoffatome eliminiert oder Alkane dehydriert.
Was sind Alkine?
Sie werden auch als acetylenische Kohlenwasserstoffe bezeichnet, die eine Dreifachbindung in der Kohlenstoffkette aufweisen. Die Struktur von Alkinen wird durch die allgemeine Formel C beschriebennX2n - 2... Es zeigt, dass Acetylenkohlenwasserstoffen im Gegensatz zu Alkanen vier Wasserstoffatome fehlen. Sie werden durch eine Dreifachbindung ersetzt, die aus zwei π-Verbindungen besteht.
Diese Struktur bestimmt die chemischen Eigenschaften dieser Klasse. Die Strukturformel von Alkenen und Alkinen zeigt deutlich die Ungesättigtheit ihrer Moleküle sowie das Vorhandensein eines Doppel (H.2C꞊CH2) und Dreifachbindungen (HC≡CH).
Der Name der Alkine und ihre Eigenschaften
Der einfachste Vertreter ist Acetylenoder HC≡CH. Es wird auch Ethin genannt. Es kommt vom Namen eines gesättigten Kohlenwasserstoffs, in dem das Suffix -an entfernt und -in hinzugefügt wird. In den Namen langer Alkine gibt die Zahl den Ort der Dreifachbindung an.
Kenntnis der Struktur von gesättigten undungesättigt kann bestimmt werden, unter welchem Buchstaben die allgemeine Formel der Alkine angegeben ist: a) CnH2n; c) CnH2n + 2; c) CnH2n-2; d) CnH2n-6. Die dritte Option ist die richtige Antwort.
Beginnend mit Acetylen und endend mit Butan (ab C.2 bis C.4) sind Substanzen gasförmiger Natur.

In flüssiger Form gibt es Kohlenwasserstoffe des homologen Intervalls von C.5 bis C.17... Ausgehend von Alkin, das 18 Kohlenstoffatome in der Hauptkette aufweist, erfolgt ein Übergang des physikalischen Zustands in eine feste Form.
Sie sind gekennzeichnet durch Isomerie im Kohlenstoffgerüst, in der Position der Dreifachbindung sowie durch Modifikationen des Moleküls zwischen den Klassen.
In Bezug auf die chemischen Eigenschaften sind acetylenische Kohlenwasserstoffe Alkenen ähnlich.
Wenn Alkin eine terminale Dreifachbindung hat, dann haben sieüben die Funktion einer Säure unter Bildung von Alkinidsalzen aus, beispielsweise NaC≡CNa. Das Vorhandensein von zwei π-Bindungen macht das Natriumacetyledinmolekül zu einem starken Nucleophil, das Substitutionsreaktionen eingeht.
Acetylen wird in Gegenwart von Kupferchlorid chloriert, um Dichloracetylen zu erhalten, Kondensation unter Einwirkung von Halogenalkinen unter Freisetzung von Diacetylenmolekülen.
Alkine sind an Additionsreaktionen beteiligtelektrophil, dessen Prinzip die Grundlage für Halogenierung, Hydrohalogenierung, Hydratisierung und Carbonylierung ist. Solche Prozesse sind jedoch schwächer als die von Alkenen mit einer Doppelbindung.
Für acetylenische Kohlenwasserstoffe sind nukleophile Additionsreaktionen von Alkohol-, primären Amin- oder Schwefelwasserstoffmolekülen möglich.








