Binære forbindelser er stoffer, der dannes af to forskellige kemiske grundstoffer. Dette udtryk bruges til at betegne den kvalitative og kvantitative sammensætning af uorganiske forbindelser.
Binære kemiske forbindelser betragtes som vigtigeobjekt i undersøgelsen af stoffernes natur. Når man beskriver dem, anvendes følgende begreber: båndpolarisering, oxidationstilstand, valens. Disse kemiske udtryk gør det muligt at forstå essensen af dannelsen af en kemisk binding, de strukturelle træk ved uorganiske stoffer.
Overvej hovedklasser af binære forbindelser, træk ved deres kemiske struktur og egenskaber og nogle områder af deres industrielle anvendelse.

Oxider
Denne klasse af uorganiske stoffer er den mest almindelige i naturen. Blandt de kendte repræsentanter for denne gruppe af forbindelser fremhæver vi:
- siliciumoxid (flodsand);
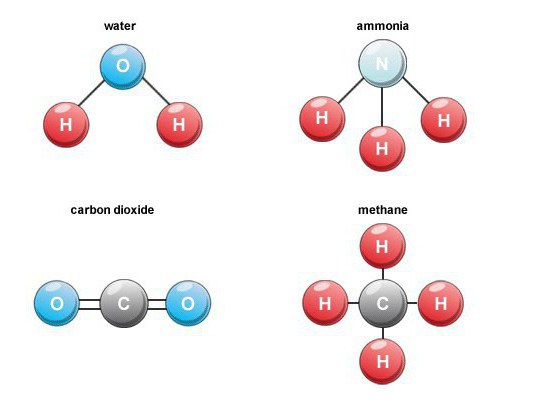
- hydrogenoxid (vand);
- carbondioxid;
- ler (aluminiumoxid);
- jernmalm (jernoxider).
Sådanne binære forbindelser er komplekse stoffer, som nødvendigvis indeholder ilt, som udviser en oxidationstilstand på -2.
Samlet tilstand af oxider
Forbindelser af kobber, calcium, jern erkrystallinske faste stoffer. Oxiderne fra nogle ikke-metaller har samme aggregeringstilstand, for eksempel hexavalent svovl, pentavalent phosphor, silicium. Væsken under normale forhold er vand. Langt størstedelen af iltforbindelser af ikke-metaller er gasser.
Uddannelsesfunktioner
Der dannes mange binære iltforbindelseri naturen. For eksempel dannes kuldioxid (kulilte 4) under forbrændingen af brændstof, vejrtrækning, nedbrydning af organisk stof. I luft er dens volumenindhold ca. 0,03 procent.
Lignende binære forbindelser er produkteraktivitet af vulkaner såvel som en integreret del af mineralvand. Kuldioxid understøtter ikke forbrænding, så denne kemiske forbindelse bruges til at slukke brande.
Flygtige hydrogenforbindelser
Sådanne binære forbindelser er en vigtig gruppe.stoffer, der indeholder brint. Blandt repræsentanter for industriel betydning bemærker vi metan, vand, hydrogensulfid, ammoniak og også hydrogenhalogenider.
Nogle af de flygtige hydrogenforbindelser er til stede i jordvand, levende organismer, så vi kan tale om deres geokemiske og biokemiske rolle.
For at komponere binære forbindelser af denne type sættes brint, som har en valens, i første omgang. Det andet element er et ikke-metal med en negativ oxidationstilstand.
At arrangere indekser i en binær sammenføjningdet mindst almindelige multiple bestemmes mellem valenser. Antallet af atomer for hvert element bestemmes ved at dividere det med valensen af hvert element, der er en del af forbindelsen.

Hydrogenchlorid
Overvej formlerne for binære forbindelser:hydrogenchlorid og ammoniak. Det er disse stoffer, der er vigtige for den moderne kemiske industri. HCI under normale forhold er en gasformig forbindelse, der er stærkt opløselig i vand. Efter opløsning af hydrogenchloridgas dannes saltsyre, som bruges i mange kemiske processer og industrielle kæder.
Denne binære forbindelse findes i mavesaften hos mennesker og dyr, det er en barriere for patogene mikrober, der trænger ind i maven med mad.
Blandt de vigtigste anvendelsesområder for saltsyre fremhæver vi produktionen af klorider, syntesen af klorholdige produkter, ætsning af metaller, rengøring af rør fra oxider og carbonater samt læderproduktion.
Ammoniak med formlen NH3, er en farveløs gas medspecifik skarp lugt. Dens ubegrænsede opløselighed i vand gør det muligt at opnå ammoniak, hvilket er efterspurgt inden for medicin. I naturen dannes denne binære forbindelse ved nedbrydning af organiske produkter, der indeholder nitrogen.

Oxidklassificering
Den iltholdige binære forbindelse af et metal med en valens på 1 eller 2 er den basiske oxid. For eksempel inkluderer denne gruppe oxider af jord- og jordalkalimetaller.
Oxider af ikke-metaller såvel som metaller med en værdi på mere end 4 er sure forbindelser.
Afhængig af de kemiske egenskaber er repræsentanter for denne klasse opdelt i saltdannende og ikke-saltdannende grupper.
Blandt de typiske repræsentanter for den anden gruppe bemærker vi kulilte (CO), nitrogenoxid 1 (NO).
Dannelse af systematiske navne på forbindelser
Blandt de opgaver, der tilbydes kandidater, der bestårtilstandseksamen i kemi, er der også dette: "Sæt de molekylære formler af mulige binære iltforbindelser af svovl (nitrogen, fosfor)." For at klare den aktuelle opgave er det nødvendigt at have en idé ikke kun om algoritmen, men også om funktionerne i nomenklaturen for denne klasse af uorganiske stoffer.
Ved dannelse af navnet på den binæreforbindelser, angiver oprindeligt det element, der er placeret til højre i formlen, og tilføjer suffikset "id". Indtast derefter navnet på det første element. For kovalente forbindelser tilføjes præfikser, som du kan etablere et kvantitativt forhold mellem de bestanddele af en binær forbindelse.
For eksempel SO3 - svovltrioxid, N2Oh4 - dinitrogen tetroxide, I2CL6 - diodehexachlorid.
Hvis et kemisk element er til stede i en binær forbindelse, der kan udvise forskellige oxidationstilstande, angives oxidationstilstanden i parentes efter navnet på forbindelsen.
For eksempel er to jernforbindelser forskellige i navn: FeCL3 - jernoxid (3), FeCL2 - jernoxid (2).
For hydrider, især ikke-metalliske elementer, bruger de trivielle navne. Så, H2O - vand, HCL - hydrogenchlorid, HI - hydrogeniodid, HF - flussyre.

Kationer
Positive ioner af de elementer, deri stand til kun at danne en stabil ion, give de samme navne som selve symbolerne. Disse inkluderer alle repræsentanter for den første og anden gruppe af Mendeleevs periodiske system.
F.eks. Har natrium- og magnesiumkationer formen: Na+, Mg2+... Overgangselementer er i stand til at danne flere typer kationer, derfor skal navnet angive den valens, der manifesteres i hvert enkelt tilfælde.
Anioner
Til enkle (monoatomiske) og komplekse (polyatomiske) anioner anvendes suffikset –id.
En udbredt oxoanion af en bestemtelementet er suffiks -am. Til oxoanion af et element i formlen med en lavere oxidationstilstand anvendes suffikset –it. For den mindste oxidationstilstand bruges præfikset hypo, og for den maksimale værdi anvendes præfikset. F.eks. Ion O2- er en oxidion, og O- - peroxid.
Der er også forskellige trivielle navne på hydrider. For eksempel N2X4 kaldet hydrazin og PH3 kaldet fosfin.
Svovlholdige oxoanioner har følgende navne:
- CO42- - sulfat
- C2Oh32- - thiosulfat;
- NCS- - thiocyanat.
Salt
Mange kemiske endelige tests antyderden næste opgave: "Lav formler til binære metalforbindelser." Hvis sådanne forbindelser indeholder anioner af chlor, brom, iod, kaldes sådanne forbindelser halogenider og tilhører klassen af salte. Når man tegner formlerne for disse binære forbindelser, sættes metallet først og derefter den tilsvarende halogenid.
For at bestemme antallet af atomer for hvert element findes det mindste multiplum mellem valenserne, og når man deler, opnås indekser.
Disse forbindelser har et højt smeltepunktog kogende, god opløselighed i vand, under normale forhold er de faste stoffer. F.eks. Findes natrium- og kaliumchlorider i havvand.
Folk har brugt bordsalt siden oldtiden.I øjeblikket er brugen af denne binære forbindelse ikke begrænset til madforbrug. Elektrolyse af en vandig opløsning af natriumchlorid producerer metallisk natrium og gasformigt chlor. Disse produkter anvendes i forskellige industrielle processer, for eksempel til produktion af natriumhydroxid, hydrogenchlorid.
Betydningen af binære forbindelser
Denne gruppe inkluderer et stort antalstoffer, derfor kan vi trygt tale om omfanget af deres anvendelse på forskellige områder af menneskelig aktivitet. Ammoniak i den kemiske industri anvendes som en forløber til fremstilling af salpetersyre til produktion af mineralgødning. Det er denne binære forbindelse, der bruges i fin organisk syntese og har været brugt i lang tid i køleenheder.
På grund af wolframcarbids unikke hårdhed,denne forbindelse har fundet anvendelse i fremstillingen af forskellige skæreværktøjer. Den kemiske inaktivitet af denne binære forbindelse gør det muligt at bruge den i aggressive miljøer: laboratorieudstyr, ovne.
Lattergas (nitrogenoxid 1) blandet med ilt bruges i medicin til generel anæstesi.
Alle binære forbindelser har en kovalent eller ionisk kemisk binding, molekylær, ionisk eller atomær krystalgitter.

konklusion
Ved udarbejdelse af formler for binære forbindelserdet er nødvendigt at følge en bestemt rækkefølge af handlinger. For det første registreres elementet, der udviser en positiv oxidationstilstand (har en lavere elektrisk negativitet). Når man bestemmer værdien af oxidationstilstanden for det andet element, trækkes det gruppetal, hvori det er placeret, fra otte. Hvis de opnåede tal adskiller sig fra hinanden, bestemmes det mindst almindelige multiple, derefter beregnes indekserne.
Ud over oxider inkluderer disse forbindelsercarbider, silicider, peroxider, hydrider. Aluminium og calciumcarbider anvendes til laboratorieproduktion af metan og acetylen; peroxider anvendes i den kemiske industri som stærke oxidanter.
Et halogenid såsom hydrogenfluorid (fluorfluorid)syre), der anvendes i elektroteknik til lodning. Blandt de vigtigste binære forbindelser, uden hvilke det er svært at forestille sig eksistensen af levende organismer, er vand i spidsen. De strukturelle træk ved denne uorganiske forbindelse studeres detaljeret i skolens kemikursus. Det er på hendes eksempel, at fyrene får en idé om rækkefølgen af handlinger, når de udarbejder formler for binære forbindelser.
Afslutningsvis bemærker vi, at det er vanskeligt at finde en sådan sfære inden for moderne industri, et område af menneskeliv, uanset hvor forskellige binære forbindelser anvendes.